ELEKTROLİZ NEDİR?
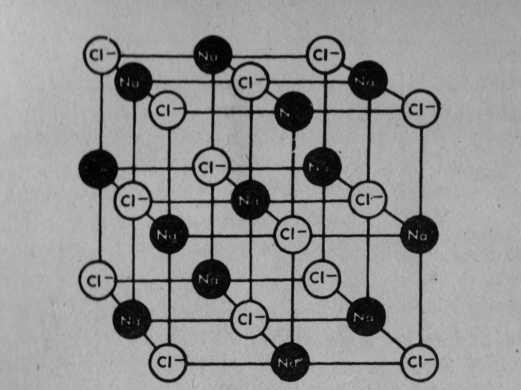
Elektrik yasalarına temel olan ilkeye göre, pozitif sodyum iyonları negatif klor iyonları tarafından çekilir. Şekilde gösterildiği gibi kristal yapısında bir bileşim yaparlar. Burada meydana gelen bileşim sodyumklorür(NaCl)dür. Başka türlü söylemek gerekirse, bildiğimiz sofra tuzu oluşmuştur. Sodyum klorür kristalleri suda eritilirse, sodyum ve klor iyonları çözüşür, serbest kalır. Bu eriyik, elektriksel bakımdan bir iletkendir.
Suda veya başka bir sıvıda eriyik halindeyken iletken olan, iletici nitelik taşıyan herhangi bir madde “elektrolit” diye tanımlanır. Tuzlar (sodyum klorür dahil), asitler ve bazlar elektrolittir. Eriyik halindeyken elektrik iletmeyen maddeler non-elektrolit olarak tanımlanır. Şeker (C12H22Oll)hepimizin bildiği bir non-elektrolittir.
İki karbon çubuğunu içinde eriyik sodyum klorür bulunan bir kavanoza koyduğumuzu ve karbon çubukların uçlarını elektrik bataryasına bağladığımızı varsayalım. Bu çubukl elektrod görevini yerine getirir. Bunlardan biri negatif elektrod (katod),öteki de pozitif elektrod (anod) durumundadır. Negatif elektrod bataryanın negatif kutbuna, pozitif elektrod bataryanın pozitif kutbuna bağlıdır.Eriyik tuzdan akım geçince, negatif elektrodda metal niteliğinde sodyum,pozitif elektrodda da klor gazı oluşur.
Başka türlü söylemek gerekirse, eriyik sodyum klorü tuzdan akım geçmesi sonucu sodyum ve klor halinde çözülüp ayrışmıştır. Bu tür bir ayrışma “elektroliz” diye adlandırılır. Kelimenin aslı Yunanca’dır. “Elektrik aracılığıyla ayrılma” anlamına gelir. Burada meydana gelen kimyasal tepki bir “elektroliz tepkisi” olarak belirtilir. Ancak, burada belirli bir noktaya önemle değinmeliyiz. Sadece bir dire (doğru) akım böyle bir tepki yaratabilir.
Daha başka tür elektroliz tepkileri de vardır. Bunların hepsi iyonların katod ve anodlara yüklenmesi esasına dayanır. Bu tür tepkiler üzerinde çalışan ilk bilim adamlarından biri 1791 ile 1867 yılları arasında yaşamış olan büyük İngiliz fizikçisi Michael Faraday’dır.
Faraday aşağıdaki elektroliz yasalarını ortaya koymuş olup, bu yasalar “Faraday yasaları” diye bilinir:
I) Elektroliz olayında bir elektrodda biriken maddenin ağırlığı doğrudan doğruya hücreden geçen elektrik miktarı ile orantılıdır.
II) Aynı miktarda elektrik tarafından oluşturulan farklı maddelerin ağırlığı, bu maddelerin ekivelan ağırlıklarıyla orantılıdır.